-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Bảng tuần hoàn hóa học là gì? Các thành phần trong bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học là một khái niệm mang tính căn bản của bộ môn Hóa học, làm nền móng cho các lý thuyết hóa học, đặc biệt trong việc dự đoán các nguyên tố mới nhờ tính chất tuần hoàn và có quy luật.
Danh mục nội dung
Trong bài viết này, Wikihoidap.org sẽ giới thiệu với bạn đọc những đặc điểm và quy tắc trong bảng tuần hoàn hóa học, cũng như một số tranh cãi xung quanh.
1. Bảng tuần hoàn hóa học là gì?
Bảng tuần hoàn hóa học đã có một lịch sử lâu dài hình thành và phát triển. Những vết tích đầu tiên của bảng tuần hoàn hóa học được ghi lại từ thế kỷ mười tám tại châu Âu.
1.1. Nguồn gốc của bảng tuần hoàn hóa học
Trong lịch sử vài trăm năm của ngành Hóa học, đã có nhiều nỗ lực hệ thống lại các nguyên tố hóa học được tìm thấy.
Năm 1789, nhà khoa học Antoine Lavoisier đã công bố bản danh sách gồm 33 nguyên tố hóa học, trong đó phân chúng thành các nhóm khí, kim loại, phi kim và “đất”. Đây chính là nỗ lực đầu tiên được ghi lại.
Đến năm 1864, Julius Lothar Mayer đưa ra bảng các nguyên tố gồm 44 nguyên tố được xếp theo hóa trị, còn William Odling cũng đưa ra 57 nguyên tố.
Trong những năm sau đó, rất nhiều nhà khoa học khác cũng công bố các công trình nghiên cứu về quy luật của các nguyên tố hóa học dựa trên nhiều tiêu chí, tuy nhiên đều không được ghi nhận nhiều trong giới chuyên môn.

Trong khi đó ở nước Anh, John Newlands đã sắp xếp các nguyên tố dựa trên khối lượng nguyên tử của chúng và ghi nhận tính tuần hoàn theo vòng lặp 8 nguyên tố. Vòng lặp này được gọi là “quãng tám” giống như các quãng trong âm nhạc.
Còn ở Hoa Kỳ, nhà khoa học Gustavus Hinrichs đã công bố bảng tuần hoàn hóa học dựa trên phổ, khối lượng nguyên tử cũng như tính chất hóa học của các nguyên tố. Tuy vậy, cả hai công bố trên đều bị phản đối mạnh mẽ trong giới học thuật.
Năm 1869, phiên bản của nhà hóa học người Nga Dmitri Mendeleev được công bố và chính thức được công nhận. Bảng tuần hoàn hóa học của ông được sắp xếp dựa trên khối lượng nguyên tử và sự lặp lại các thuộc tính của các nguyên tố.
Từ đó, phiên bản này trở thành phiên bản phổ biến nhất và được sử dụng chính thức trong các chương trình nghiên cứu, tài liệu cũng như sách giáo khoa trong trường học.
UNESCO chọn năm 2019 là năm Kỷ niệm Bảng tuần hoàn các nguyên tố hóa học Quốc tế.
1.2. Khái niệm và đặc điểm bảng tuần hoàn hóa học
Theo bản của Dmitri Mendeleev, bảng tuần hoàn hóa học, còn gọi là bảng tuần hoàn các nguyên tố hóa học hay bảng tuần hoàn Mendeleev, là một dạng liệt kê các nguyên tố thành các ô theo thứ tự số hiệu nguyên tử và các thuộc tính mang tính tuần hoàn.
Ngoài các nguyên tố được trình bày, trong bảng còn có các ô trống thể hiện rằng vẫn còn các nguyên tố khác chưa được khám phá, nhưng tính tuần hoàn sẽ giúp dự đoán các nguyên tố mới này.
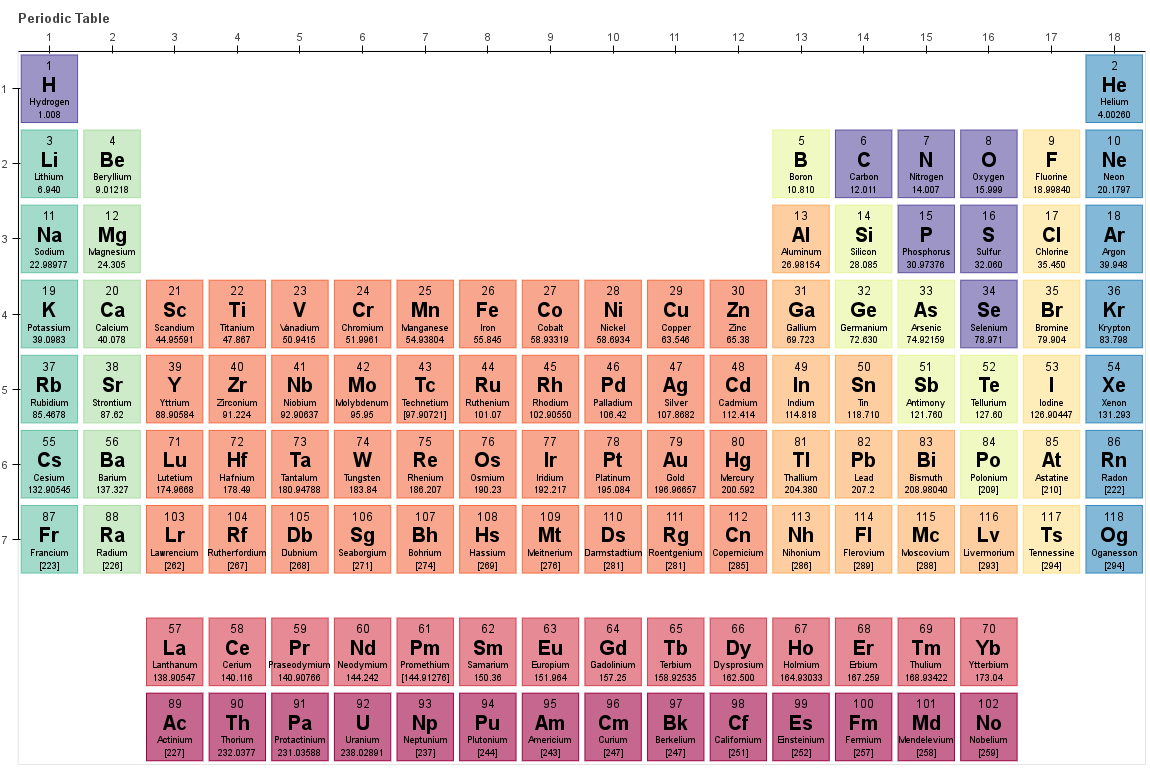
Hiện tại, phiên bản mới nhất của bảng tuần hoàn hóa học có 118 nguyên tố, với 4 nguyên tố mới ununtrium, ununpentium, ununseptium và ununoctium được các nhà khoa học người Nga, Mỹ, Nhật tìm ra năm 2016.
2. Các thành phần trong bảng tuần hoàn hóa học
Bảng tuần hoán hóa học có ba thành phần chính là nhóm, chu kỳ và khối. Các thành phần này đều thể hiện những quy luật của bảng tuần hoàn hóa học.
2.1. Nhóm trong bảng tuần hoàn hóa học
Trong bảng tuần hoàn hóa học, một nhóm các nguyên tố sẽ bao gồm các nguyên tố có cấu hình electron giống nhau trong lớp hóa trị. Chính sự tương đồng này đã tạo này tính chất hóa học tương tự nhau cho dù các nguyên tố này khác về số hiệu nguyên tử (số proton trong nguyên tử của nguyên tố đó).
Các nhóm sẽ được phân ra làm các cột và có tổng cộng mười tám cột trong bảng tuần hoàn hóa học, trong đó có tám cột chính và mười cột phụ.
Từ trái sang phải, các nhóm nguyên tố được xếp theo thứ tự từ kim loại mang tính kiềm (như Natri, Bari), kiềm thổ (nhôm) đến các khí hiế (như khí Heli).
Trong một nhóm, nếu đi từ trên xuống dưới, bán kính nguyên tử của các nguyên tố sẽ tăng dần, điều này khiến cho các nguyên tố ở dưới có nhiều lớp electron hơn và làm yếu đi liên kết giữa các electron trong nguyên tử đó.
Chính vì thế, độ âm điện của các nguyên tố ở dưới cũng thấp hơn. Điều này trên thực tế được ứng dụng vào việc xác định tính chất kim loại của các nguyên tố, nếu độ âm điện lớn tức là nguyên tố đó có tính kim loại yếu và ngược lại thì có tính kim loại mạnh.
2.2. Chu kỳ của bảng tuần hoàn các nguyên tố
Bảng tuần hoàn hóa học Medeleev có giá trị lớn bởi chúng sắp xếp các nguyên tố theo chu kỳ. Chu kỳ ở đây được xác định là số lớp electron của nguyên tử, các nguyên tố trong cùng hàng ngang sẽ có cùng số lớp electron đó.
Tính từ trái sang phải, số proton trong các nguyên tử tăng dần, khiến các electron được kéo gần hạt nhân nguyên tử. Điều này làm cho liên kết electron mạnh hơn, đồng nghĩa với độ âm điện cũng tăng.
Do đó, các nguyên tố ở bên trái của hàng thường là kim loại, còn các nguyên tố bên phải thường là phi kim hoặc khí hiếm. Trong đó, kim loại có đặc trưng là có ánh kim, khả năng dẫn nhiệt và dẫn điện tốt, còn phi kim thường là chất khí, cách nhiệt và cách điện.
Giữa hai nhóm này có một nhóm gọi là á kim, mang tính chất chuyển tiếp giữa kim loại và phi kim.
2.3. Các khối của bảng tuần hoàn hóa học
Bảng tuần hoàn hóa học được chia thành các khối chính là khối s, khối f, khối d và khối p tương ứng với tên của lớp electron cuối cùng của các nguyên tố. Thứ tự từ trái sang phải của các khối này là khối s, khối f, khối d và cuối cùng là khối p.
Trong đó, khối p bao gồm sáu nhóm từ nhóm mười ba đến nhóm mười tám, khối d từ nhóm thứ ba đến nhóm mười hai, khối s gồm hai cột đầu tiên, còn nhóm f được xếp riêng bên dưới bảng tuần hoàn hóa học.
3. Một số hạn chế của bảng tuần hoàn hóa học
Trong bảng tuần hoàn các nguyên tố, vị trí của một số nguyên tố không thích ứng với tính chất của chúng. Chẳng hạn, nguyên tố hiđrô và heli có vị trí không tương thích với cấu hình lớp electron.
Ngoài ra, một số nguyên tố chuyển tiếp giữa phi kim và kim loại khi đặt trong bảng tuần hoàn lại không đúng vị trí, điều này đã gây ra bất đồng quan điểm trong giới học thuật.
Mặc dù vậy, không thể phủ nhận những đóng góp to lớn của bảng tuần hoàn hóa học cho ngành khoa học này. Chúng giúp việc tiên đoán các nguyên tố mới trở nên chuẩn xác, đồng thời được ứng dụng nhiều trong thực tế.
Không chỉ vậy, bảng tuần hoàn còn giúp giải thích các phản ứng hóa học, giải thích các tính chất của nguyên tố và là nền móng cho ngành khoa học nguyên tử.
LỜI KẾT
Với bài viết này, Kinhcan.vn hi vọng sẽ cung cấp cho bạn đọc những kiến thức cơ bản nhất về bảng tuần hoàn hóa học để giúp bạn bước đầu tìm hiểu về phát minh vô cùng vĩ đại trong lịch sử hóa học.



