-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Cách xác định số oxi hóa?
Trong lĩnh vực hóa học, việc xác định số oxi hóa của một chất hay ion là việc hết sức quan trọng, không chỉ phục vụ cho việc giải bài tập mà còn là nền tảng cho việc nghiên cứu chuyên sâu hơn vào ngành hóa. Hãy cùng Wikihoidap.org tìm hiểu nhé!
Danh mục nội dung
Cách xác định số oxi hóa:
Xác định số oxi hóa dựa trên quy tắc hóa học:
- Xác định xem chất cần phân tích là đơn chất hay hợp chất. Các nguyên tử ở trạng thái tự do, không liên kết với các nguyên tử khác luôn có số oxi hóa bằng 0.
- Ví dụ, Al và H2 đều có số oxi hóa bằng 0 vì chúng đang ở dạng đơn chất hay không liên kết.
- Chú ý rằng lưu huỳnh dạng tà phương S8 một dạng tồn tại hiếm gặp của lưu huỳnh, cũng có số oxi hóa bằng 0.
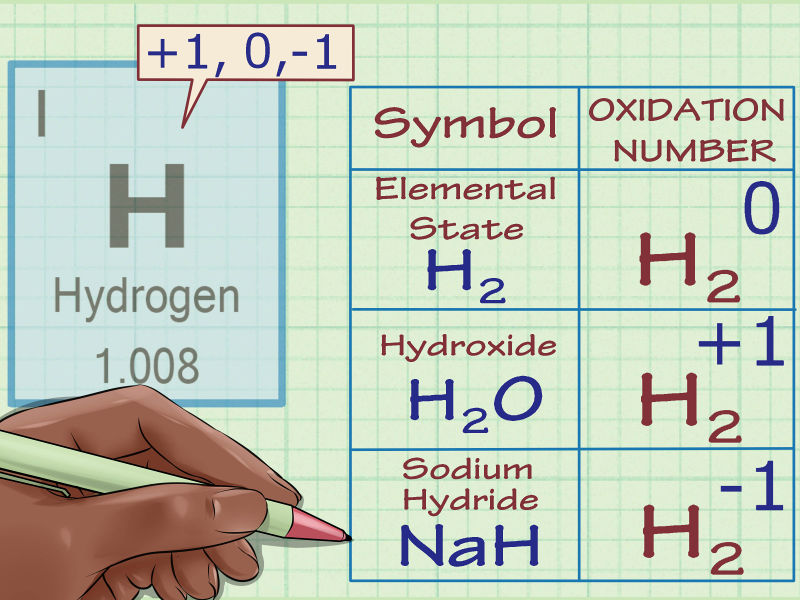
- Xác định chất cần xác định có phải là ion không? Đối với ion, số oxi hóa bằng chính số điện tích của ion. Quy tắc này áp dụng với cả ion tự do và ion trong các hợp chất.
- Ví dụ, ion Cl- có số oxi hóa là -1.
- Trong hợp chất NaCl, ion Cl vẫn có số oxi hóa là -1. Vì theo định nghĩa, ion Na có điện tích là +1, ta cũng biết ion Cl có điện tích là -1, vì thế số oxi hóa của ion Cl cũng là -1.
- Ion kim loại có thể có nhiều số oxi hóa. Các ion kim loại có thể có một hoặc nhiều điện tích. Ví dụ, ion sắt (Fe) có thể có điện tích là +2 hoặc + Điện tích của kim loại (cũng là số oxi hóa) có thể được xác định dựa trên mối quan hệ với điện tích của nguyên tử khác trong hợp chất, hoặc xác định bằng ký hiệu số la mã ở dạng chữ (ví dụ trong câu "Ion sắt (III) có điện tích là +3.")
- Ví dụ, xét một hợp chất có chứa ion nhôm kim loại. Hợp chất AlCl3 có tổng điện tích bằng 0. Bởi ta đã biết ion Cl- có điện tích là -1 và có 3 ion Cl- trong hợp chất, vì thế, để tổng điện tích của hợp chất bằng 0, ion Al phải có điện tích là +3. Do đó, số oxi hóa của Al là +3.
- Oxi có số oxi hóa là -2 (trừ một số trường hợp đặc biệt). Trong ‘’phần lớn’’ các trường hợp, nguyên tử oxi có số oxi hóa là -2, trừ các trường hợp sau:
- Khi oxi ở trạng thái đơn chất (O2), số oxi hóa là 0, tương tự đối với các nguyên tử nguyên tố khác.
- Khi oxi nằm trong hợp chất ‘’peoxit’’, số oxi hóa của oxi là -1. Peoxit là một nhóm hợp chất có liên kết đơn giữa hai nguyên tử oxi (hay anion O22-). Ví dụ, trong phân tử H2O2 (nước oxi già), oxi có số oxi hóa (và điện tích) là -1. Tương tự, khi oxi nằm trong gốc oxi hóa hoạt tính cao (supeoxit), số oxi hóa của oxi là -0,5.
- Khi oxi liên kết với flo, số oxi hóa của nó là +2. Ta sẽ xét quy tắc đối với các hợp chất chứa Flo ở phần sau. Trong hợp chất (O2F2), số oxi hóa của oxi là +1.
- Flo luôn luôn có số oxi hóa là -1, như đã nêu ở trên, số oxi hóa của một số nguyên tố có thể thay đổi do nhiều nguyên nhân (như trường hợp ion kim loại, nguyên tử oxi trong peoxit, v.v.). Tuy nhiên, số oxi hóa của Flo không thay đổi và bằng -1 trong tất cả các hợp chất có chứa nguyên tố này. Sở dĩ như vậy là vì flo là nguyên tố có độ âm điện lớn nhất – hay nói cách khác, nguyên tử Flo khó mất electron nhất so với nguyên tử các nguyên tố khác, ngược lại lại rất dễ hút electron từ nguyên tử nguyên tố khác. Vì thế, điện tích của Flo không thay đổi.
- Số oxi hóa của một hợp chất bằng điện tích của hợp chất đó. Tổng số oxi hóa của tất cả các nguyên tử trong một hợp chất phải bằng điện tích của hợp chất đó. Ví dụ, nếu một hợp chất không tích điện thì tổng số oxi hóa của mỗi nguyên tử trong hợp chất đó phải bằng 0; nếu điện tích của một hợp chất cấu thành bởi nhiều ion bằng -1 thì tổng số oxi hóa của các ion cấu thành hợp chất đó phải là -1.
- Đây là một cách khá hay để kiểm tra lại kết quả bạn tìm được. Nếu tổng các số oxi hóa của các nguyên tử trong hợp chất không bằng tổng điện tích của chất đó thì có lẽ bạn đã gán hoặc tính toán nhầm ở đâu đó.
.jpg)
Tìm số oxi hóa cho các nguyên tử không có quy tắc riêng về số oxi hóa:
- Một số nguyên tử không tuân theo một quy tắc nhất định nào về số oxi hóa. Nếu nguyên tử đó không tuân theo quy tắc đã nêu ở phần trên và bạn không biết rõ điện tích của nguyên tử đó (ví dụ, nguyên tử này là một phần của một hợp chất lớn hơn, do đó điện tích của nguyên tử không được cho trước), bạn có thể tìm được số oxi hóa của nguyên tử đó bằng cách loại trừ. Đầu tiên, bạn cần xác định số oxi hóa của tất cả các nguyên tử khác trong hợp chất, sau đó chỉ cần giải bài toán tìm số chưa biết dựa trên điện tích tổng của hợp chất.
- Ví dụ, trong hợp chất Na2SO4, ta chưa biết điện tích của lưu huỳnh (S) – đồng thời nguyên tử lưu huỳnh lúc này không ở trạng thái đơn chất, vì thế số oxi hóa của nó khác 0. Đây là ví dụ mà ta sẽ dùng trong phần này.
- Tìm số oxi hóa của các nguyên tử nguyên tố khác trong hợp chất. Sử dụng các quy tắc gán số oxi hóa ở phần trên, ta có thể tìm được số oxi hóa của các nguyên tử nguyên tố khác trong hợp chất. Hãy nhớ xét các trường hợp ngoại lệ đối với O, H, v.v.
- Trong Na2SO4, dựa trên các nguyên tắc đã nêu, ta biết rằng ion Na có điện tích (cũng là số oxi hóa) là +1, nguyên tử oxi có số oxi hóa là -2.
- Nhân số nguyên tử của mỗi nguyên tố với số oxi hóa của chúng. Sau khi xác định được số oxi hóa của tất cả các nguyên tử trừ ẩn số ta cần tìm, ta cần xét số lượng nguyên tử của cùng một nguyên tố trong hợp chất là bao nhiêu. Nhân số này (chỉ số được viết dưới chân và nằm sau kí hiệu hóa học nguyên tố đó trong hợp chất) với số oxi hóa.
- Trong Na2SO4, ta thấy có 2 nguyên tử Na, 4 nguyên tử O. Vậy ta có 2 × +1, số oxi hóa của Na, được 2, và 4 × -2, số oxi hóa của O, được -8.
- Cộng tổng các tích số tìm được. Cộng các tích số tìm được ta sẽ xác định được số oxi hóa của hợp chất mà ‘’không’’ xét đến số oxi hóa cần tìm.
- Trong ví dụ về Na2SO4, ta có tổng của 2 và -8 là -6.
- Tính số oxi hóa cần tìm dựa trên điện tích của hợp chất. Bằng các giá trị đã tính được, ta chỉ cần thực hiện phép tính cộng trừ đơn giản để tìm được số oxi hóa của nguyên tố đang xét. Lập một phương trình trong đó điện tích của hợp chất bằng tổng kết quả thu được ở bước trước cộng với số oxi hóa cần tìm. Hay nói cách khác là: (Tổng các số oxi hóa đã biết) + (số oxi hóa cần tìm) = (điện tích tổng của hợp chất).
Trong ví dụ về Na2SO4, ta có:
- (Tổng các số oxi hóa đã biết) + (số oxi hóa cần tìm) = (điện tích tổng của hợp chất)
- -6 + S = 0
- S = 0 + 6
- S = 6. Vậy S có số oxi hóa là +6 trong hợp chất Na2SO4.
Lời khuyên:
- Trong một hợp chất không tích điện, tổng tất cả các số oxi hóa của các nguyên tử trong hợp chất phải bằng 0. Nếu có một ion gồm 2 nguyên tử, tổng các số oxi hóa phải bằng điện tích của ion đó.
- Biết cách đọc bảng tuần hoàn các nguyên tố hóa học và cách xác định vị trí các nguyên tố trong bảng tuần hoàn rất hữu ích trong bài toán xác định số oxi hóa.
- Các nguyên tử trong một đơn chất có số oxi hóa bằng 0. Một ion đơn nguyên tử có số oxi hóa bằng điện tích của ion đó. Nguyên tử các kim loại nhóm 1A ở trạng thái nguyên tố, ví dụ như khí hidro, đơn chất liti và natri, có số oxi hóa là +1; nguyên tử các kim loại nhóm 2A ở trạng thái nguyên tố, ví dụ như kim loại magie, canxi, có số oxi hóa là +2. Số oxi hóa của nguyên tử hidro và nguyên tử oxi phụ thuộc vào nguyên tử mà nó liên kết và loại liên kết.
- Một số mẹo giúp bạn có thể xác định sự khác nhau giữa sự oxi hóa và sự khử:
- O (oxi hóa) cho, khử nhận.
- Nguyên tử kim loại có xu hướng mất electron và tạo thành ion dương (sự oxi hóa)
- Nguyên tử phi kim và á kim có xu hướng nhận electron và tạo thành ion âm (sự khử).
- Một ion cũng có thể nhận hoặc cho đi electron để trở thành một ion có điện tích khác ion ban đầu, hoặc trở thành một nguyên tử trung hòa điện.
Hy vọng sau bài viết này, đã giải đáp được những thắc mắc về cách xác định số oxi hóa mà biết bao thế hệ học sinh phải vò đầu, bứt tóc, phong Hóa thành môn khó nhằn nhất trong lịch sử phổ thông. Đã có Wikihoidap.org hỗ trợ bạn trong việc này, yên tâm và đón chờ các bài viết mới của chúng tôi nhé!



