-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Liên kết cộng hóa trị là gì? Chuyên đề liên kết cộng hóa trị
Liên kết hóa học là kiến thức căn bản của hóa học lớp 10, đặc biệt là liên kết cộng hóa trị, chúng ta gặp rất nhiều trong chương trình. Cùng Wikihoidap.org tìm hiểu kỹ loại liên kết này nhằm học tốt môn hóa ở chương trình phổ thông nhé!
Danh mục nội dung
Liên kết cộng hóa trị là gì?
Liên kết cộng hóa trị, còn gọi là liên kết phân tử là một liên kết hóa học được hình thành bằng việc dùng chung một hay nhiều cặp electron giữa các nguyên tử. Những cặp electron này được gọi là cặp electron dùng chung, và sự cân bằng lực hút và lực đẩy giữa các nguyên tử trong khi chia sẻ các electron được gọi là liên kết cộng hóa trị. Với nhiều phân tử, việc dùng chung electron cho phép mỗi nguyên tử đạt được cấu hình electron bền vững.
Loại liên kết này cũng có thể được tìm thấy nhiều trong hóa học, chẳng hạn như các gốc và đại phân tử. Thuật ngữ “liên kết cộng hóa trị” lần đầu tiên được sử dụng vào năm 1939, mặc dù Irving Langmuir đã đưa ra thuật ngữ “cộng hóa trị” vào năm 1919 để mô tả số lượng cặp electron được chia sẻ bởi các nguyên tử lân cận.
Quy tắc bát tử là gì?
Quy tắc bát tử là tất cả các nguyên tử trong một phân tử có electron hóa trị 8 hoặc bằng cách chia sẻ, mất hoặc sau khi được electron để được giá trị 8. Đối với liên kết phân tử, các nguyên tử có xu hướng chia sẻ các electron của chúng với nhau để thỏa mãn quy tắc Octet. Nó đòi hỏi 8 electron vì đó là lượng electron cần thiết để lấp đầy một cấu hình electron lớp s hoặc p.
Sự hình thành liên kết cộng hóa trị bằng cặp electron chung
Sự hình thành phân tử đơn chất
- Sự hình thành phân tử Hidro H2
H : 1s1 và He : 1s2
Sự hình thành phân tử H2 : H.+.H → H:H
Mỗi chấm bên kí hiệu nguyên tố biểu diễn một electron ở lớp ngoài cùng, H:H được gọi là công thức electron. Thay hai chấm bằng 1 gạch, ta có H−H gọi là công thức cấu tạo. Giữa 2 nguyên tử hiđro có 1 cặp electron liên kết biểu thị bằng một gạch (−), đó là liên kết đơn.
Sự hình thành phân tử N2
N : 1s22s22p3
Ne : 1s22s22p6
:N + N: à : NN : à N≡N
Công thức electron Công thức cấu tạo
* Hai nguyên tử N liên kết với nhau bằng 3 cặp electron liên kết biểu thị bằng 3 gạch, đó là liên kết ba. Liên kết 3 bền hơn liên kết đôi.
Sự hình thành hợp chất
Sự hình thành phân tử HCl
Trong phân tử hiđro clorua, mỗi nguyên tử ( H và Cl ) góp 1 electron tạo thành 1 cặp electron chung để tạo nên một liên kết cộng hóa trị. Độ âm điện của Clo là 3,16 lớn hơn độ âm điện của hiđro là 2,20 nên cặp electron liên kết bị lệch về phía Clo, liên kết cộng hóa trị này bị phân cực.

Liên kết cộng hóa trị trong đó cặp electron chung bị lệch về phía một nguyên tử được gọi là liên kết cộng hóa trị có cực hay liên kết cộng hóa trị phân cực.
Sự hình thành phân tử khí cacbonic CO2 (có cấu tạo thẳng)
Cấu hình electron nguyên tử của C (Z=6) là 1s22s22p2, nguyên tử cacbon có 44 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử của O (Z=8) là 1s22s22p4, nguyên tử oxi có 6 electron ở lớp ngoài cùng.
Trong phân tử CO2, nguyên tử C nằm giữa 2 nguyên tử O và góp chung với mỗi nguyên tử O hai electron, mỗi nguyên tử O góp chúng với nguyên tử C hai electron tạo ra 2 liên kết đôi.
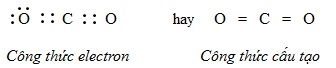
Kết luận: Theo công thức electron, mỗi nguyên tử C hay O đều có 8e ở lớp ngoài cùng đạt cấu hình của khí hiếm nên phân tử CO2 bền vững.
Liên kết cho - nhận
Trong một số trường hợp, cặp electron chung chỉ do một nguyên tử đóng góp thì liên kết giữa hai nguyên tử là liên kết cho - nhận.

Tính chất
Các chất mà phân tử chỉ có liên kết cộng hóa trị có thể là chất rắn như đường, lưu huỳnh, iot,..., có thể là chất lỏng: nước, ancol,... hoặc chất khí như khí cacbonic, clo, hiđro,... Các chất có cực như ancol etylic, đường,... tan nhiều trong dung môi có cực như nước. Phần lớn các chất không cực như iot, các chất hữu cơ không cực tan trong dung môi không cực như benzen, cacbon tetraclorua,...
Nói chung, các chất chỉ có liên kết cộng hóa trị không cực không dẫn điện ở mọi trạng thái.
Các loại liên kết cộng hóa trị
Liên kết đơn phân tử
Một liên kết đơn là khi 2 phân tử đều chia sẽ 1 cặp electron duy nhất. Mặc dù dạng liên kết này yếu hơn và có mật độ nhỏ hơn liên kết đôi và liên kết ba, nhưng nó ổn định nhất vì nó có mức độ phản ứng thấp hơn đồng nghĩa với việc ít bị ảnh hưởng hơn khi mất electron trước các nguyên tử muốn đánh cắp electron.
Ví dụ: Liên kết phân tử giữa nguyên tử H2 và Cl2 sẽ tạo thành axit HCl.
Liên kết đôi phân tử
Liên kết đôi là khi hai nguyên tử chia sẻ hai cặp electron với nhau. Nó được mô tả bởi hai đường ngang giữa hai nguyên tử trong một phân tử. Loại liên kết này mạnh hơn nhiều so với liên kết đơn, nhưng kém ổn định hơn.
Ví dụ: Khí CO2
Liên kết 3 phân tử
Liên kết ba là khi ba cặp electron được chia sẻ giữa hai nguyên tử trong một phân tử. Nó là loại kém ổn định nhất trong các loại liên kết phân tử.
Ví dụ: C2H2
Liên kết hóa trị có cực
Một liên kết cộng hóa trị có cực được tạo ra khi các electron dùng chung giữa các nguyên tử không được chia sẻ như nhau. Điều này xảy ra khi một nguyên tử có độ âm điện cao hơn nguyên tử mà nó đang chia sẻ.
Nguyên tử có độ âm điện cao hơn sẽ có lực hút mạnh hơn đối với các điện tử. Do đó, các electron được chia sẻ sẽ ở gần nguyên tử hơn với độ âm điện cao hơn, khiến nó được chia sẻ không đồng đều.
Liên kết hóa trị không cực
Một liên kết hóa trị không cực được tạo ra khi các nguyên tử chia sẻ các electron bằng nhau. Điều này thường xảy ra khi hai nguyên tử có lực tương tự hoặc cùng điện tử. Các giá trị của lực điện tử của chúng càng gần, sức hút càng mạnh.
Điều này xảy ra trong các phân tử khí, còn được gọi là các yếu tố diatomic. Liên kết phân tử không cực có khái niệm tương tự như liên kết phân tử có cực. Nguyên tử có độ âm điện cao hơn sẽ hút electron khỏi hạt yếu hơn.
So sánh liên kết cộng hóa trị không cực, có cực và liên kết ion
- Giống nhau: Các nguyên tử kết hợp với nhau tạo ra mỗi electron ngoài cùng bền vững giống cấu trúc của khí hiếm (quy tắc bát tử).
- Khác nhau:
|
|
Cộng hóa trị không cực |
Cộng hóa trị có cực |
Liên kết ion |
|
Sự hình thành liên kết |
Cặp e ở giữa 2 nguyên tử |
Cặp e chung nằm phía nguyên tử có độ âm điện lớn hơn |
Nguyên tử kim loại nhường e, nguyên tử phi kim nhận e |
|
Điều kiện liên kết |
Giữa 2 phi kim giống hệt nhau |
Giữa 2 phi kim mạnh yếu khác nhau |
Giữa kim loại điển hình và phi kim điển hình |



