-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Etanol, ancol etylic là chất gì? Tính chất và ứng dụng
Etanol, ancol etylic, rượu etylic hay cồn là các tên gọi đều chỉ một chất hóa học hiện diện rất nhiều xung quanh chúng ta, với rất nhiều công dụng và lợi ích khác nhau. Đặc biệt, chất này luôn xuất hiện nhan nhản trong các bài toán dành cho các học sinh cấp 2 khiến biết bao nhiêu thế hệ phải đau đầu mà bình chọn hóa học là một trong các môn học khó xơi nhất, đối với các bạn thôi, chứ đối với ad là hóa phổ thông là ba đồ muỗi, ez game :D:D:D. Nào cùng ad tìm hiểu kỹ hơn về chất hóa học này nhé.
Danh mục nội dung
Ancol etylic là gì
Như ad nói ở trên, Etanol, còn được biết đến như là rượu etylic, ancol etylic, rượu ngũ cốc hay cồn, là một hợp chất hữu cơ nằm trong dãy đồng đẳng của ancol, dễ cháy, không màu, là một trong các rượu thông thường có trong thành phần của đồ uống chứa cồn. Trong cách nói dân dã, thông thường nó được nhắc đến một cách đơn giản là rượu, cứ nhắc đến việc đi mua rượu trong các dịp lễ, giỗ là auto nghĩ đến Etanol. Nhớ nhé!
Etanol là một ancol mạch hở, công thức hóa học của nó là C2H6O hay C2H5OH. Một công thức thay thế khác là CH3-CH2-OH thể hiện cacbon ở nhóm metyl (CH3–) liên kết với carbon ở nhóm metylen (–CH2–), nhóm này lại liên kết với oxy của nhóm hydroxyl (–OH). Nó là đồng phân nhóm chức của dimetyl ete (CH3-O-CH3). Etanol thường được viết tắt là EtOH, sử dụng cách ký hiệu hoá học thường dùng đại diện cho nhóm etyl (-C2H5) là Et.
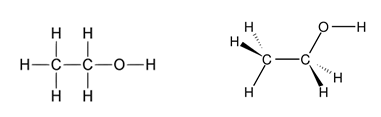
Các liên kết hydro làm cho etanol nguyên chất có tính hút ẩm, làm chúng sẵn sàng hút hơi nước trong không khí. Sự phân cực tự nhiên của nhóm chức hydroxyl làm cho etanol có thể hòa tan một số hợp chất ion như Na và KOH, MgCl2, CaCl2. Na và KCl ít tan trong etanol. Do phân tử etanol có một đầu không phân cực, nó cũng sẽ hòa tan các hợp chất không phân cực, bao gồm hầu hết tinh dầu và nhiều chất hương liệu, màu, và thuốc.
Tính chất vật lý của Ancol etylic
Etanol là chất lỏng, không màu, sôi ở 78,3 độ C, nhẹ hơn nước, tan vô hạn trong nước, là dung môi hòa tan được nhiều chất, điển hình là iot, benzen...
Bên cạnh đó, chúng ta còn quan tâm đến một khái niệm khác liên quan đến etanol đó là độ rượu.
Độ rượu = 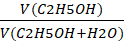 x 100
x 100
V là thể tích đo bằng ml hoặc lít.
Tính chất hóa học của Ancol etylic
Phản ứng cháy
Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt.
C2H5OH + 3O2 à 2CO2 + 3H2O + Q(tỏa nhiệt)
Tác dụng với kim loại mạnh như K, Na,...
2C2H5OH + Na à 2C2H5ONa + H2
Tác dụng với axit (Phản ứng este hóa)
Thí dụ: Tác dụng với axit axetic có H2SO4 đặc tạo ra este và nước
CH3COOH + HO – C2H5 à CH3COOC2H5 + H2O
Phản ứng loại nước như tách nước trong một phân tử để tạo thành olefin, trong môi trường axit sulfuric đặc ở 170 độ C
C2H5OH à C2H4 + H2O
Phản ứng oxi hóa, trong đó rượu bị oxi hóa theo 3 mức: (hữu hạn) thành aldehyde, axit hữu cơ và oxi hóa hoàn toàn (đốt cháy) thành CO2 và H2O. Ví dụ ở mức 1, trong môi trường nhiệt độ cao
CH3-CH2-OH + CuO à CH3-CHO + Cu + H2O
Mức 2, có xúc tác:
CH3-CH2-OH + O2 à CH3-COOH + H2O
Mức 3
C2H5OH + 3 O2 à 2 CO2 + 3 H2O
Ứng dụng của Etanol
Ứng dụng của etanol thì vô vàn thứ để kể, nhiều khi mấy nhóc trẻ trâu đã sử dụng các thành phẩm của chất này mà cũng chả biết.
Rượu etylic được dùng làm nhiên liệu cho động cơ ôtô, cho đèn cồn trong phòng thí nghiệm. Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp; dùng pha chế các loại rượu uống,...

Mối nguy ngại
- Etanol và hỗn hợp của nó với nước chứa trên 50% etanol (cồn 50 độ trở lên) là các chất dễ cháy và dễ dàng bắt lửa.
- Etanol trong cơ thể người được chuyển hóa thành axetandehit do enzym alcohol dehydrogenas phân hủy rượu và sau đó thành axít axêtic bởi enzym axetandehit dehydrogenas phân hủy axetandehit. axetandehit là một chất có độc tính cao hơn so với etanol. axetandehit cũng liên quan tới phần lớn các triệu chứng lâm sàng liên quan tới rượu. Người ta đã thấy mối liên quan giữa rượu và các nguy cơ của bệnh xơ gan, nhiều dạng ung thư và chứng nghiện rượu.
- Mặc dù etanol không phải là chất độc có độc tính cao, nhưng nó có thể gây ra tử vong khi nồng độ cồn trong máu đạt tới 0,4%. Nồng độ cồn tới 0,5% hoặc cao hơn nói chung là dẫn tới tử vong. Nồng độ thậm chí thấp hơn 0,1% có thể sinh ra tình trạng say, nồng độ 0,30,4% gây ra tình trạng hôn mê. Tại nhiều quốc gia có luật điều chỉnh về nồng độ cồn trong máu khi lái xe hay khi phải làm việc với các máy móc thiết bị nặng, thông thường giới hạn dưới 0,05% tới 0,08%. Rượu mêtylic hay metanol là rất độc, không phụ thuộc là nó vào cơ thể theo cách nào (da, hô hấp, tiêu hóa).
- Người ta cũng đã chỉ ra mối liên quan tỷ lệ thuận giữa etanol và sự phát triển của Acinetobacter baumannii, vi khuẩn gây ra viêm phổi, viêm màng não và các viêm nhiễm hệ bài tiết. Sự phát hiện này là trái ngược với sự nhầm lẫn phổ biến cho rằng uống rượu có thể giết chết nhiều loại vi khuẩn gây các bệnh truyền nhiễm
Cách điều chế Ancol Etylic
Tinh bột hoặc đường men → men Rượu etylic.
Cho etylen cộng hợp với nước có axit làm xúc tác
CH2 = CH2 + H2O à C2H5OH
Chú ý : Những hợp chất hữu cơ, phân tử có nhóm OH, có công thức phân tử chung là CnH2n+1OH gọi là ancol no đơn chức hay ankanol cũng có tính chất tương tự rượi etylic.

Luyện tập
Người ta sản xuất ancol etylic từ tinh bột. Từ 1 tấn sắn chứa 70% tinh bột thì khối lượng ancol thu được là bao nhiêu (biết rằng hao hụt trong quá trình sản xuất là 15%)?
A. 337,9 kg
B. 347,5 kg
C. 339,9 kg
D. kết quả khác
Đáp án:
Đáp án A
Hướng dẫn
Ta có sơ đồ:
(C6H10O5)n → 2nC2H5OH
m(C6H10O5)n = 1000 x 70% = 700 kg.
Theo phương trình:
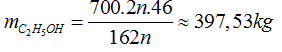
Mà hao hụt 15% → mC2H5OH = 398 x 85% = 337,9 kg



