-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Axit sunfuric là gì? H2SO4 là chất gì?
Tiếp tục chuyên mục bài viết về nguyên tố lưu huỳnh, cũng như các hợp chất của chúng. Trong bài viết này, Wikihoidap.org sẽ tìm hiểu cùng với bạn đọc về hợp chất tiêu biểu nhất của lưu huỳnh, để kết thúc chuyên mục, đó là H2SO4 hay còn gọi là axit sunfuric. Nào cùng tìm hiểu nhé!
Danh mục nội dung
H2SO4 là chất gì?
Trước khi tìm hiểu sâu hơn về đặc tính cũng như là tính chất của loại hóa chất này, chúng ta sẽ có cái nhìn cơ bản ban đầu, đây là một axit vô cơ gồm các nguyên tố lưu huỳnh, oxy và hydro với công thức hóa học là H2SO4. Đây là đặc điểm nhận dạng ban đầu về hóa chất này, tiếp theo là tìm hiểu về tính chất vật lý nhé.
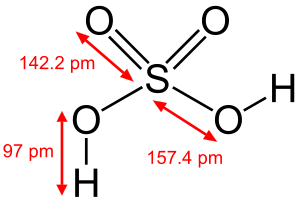
Tính chất vật lý:
Axit sunfuric là hóa chất lỏng không màu, không mùi và sánh, hòa tan trong nước, tan vô hạn trong nước và toả rất nhiều nhiệt, khó bay hơi và một phản ứng tỏa nhiệt cao.
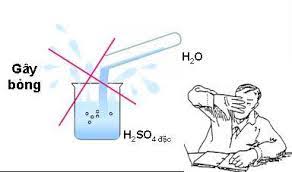
Axit sunfuric đặc thường hút mạnh nước và tỏa nhiều nhiệt nên khi pha loãng phải cho từ từ axit đặc vào nước mà không làm ngược lại, vì H2SO4 có thể gây bỏng.
Axit sunfuric còn có khả năng làm than hóa các hợp chất hữu cơ.
Tính chất hóa học:
Sau khi tìm hiểu về tính chất vật lý, chúng ta sẽ tìm hiểu các đặc trưng trong tính chất hóa học diệu kỳ này nhé. Hãy theo chân Wikihoidap.org nào!
a, Tính chất axit sunfuric loãng:
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat:
Zn + H2SO4 → ZnSO4 + H2
* Lưu ý:
nH2 = nH2SO4
mmuối = mkim loại + mH2SO4 - mH2 = mkim loại + 96nH2
Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước
ZnO + H2SO4 → ZnSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
Lưu ý: Thường dùng phương pháp tăng giảm khối lượng khi giải bài tập về phản ứng của axit sunfuric với muối.
b, Tính chất axit sunfuric đặc:
Số oxi hóa của lưu huỳnh: -2 0 +4 +6
* Nhận xét: S trong H2SO4 có mức oxi hóa +6 cao nhất.
→ H2SO4 đặc có tính axit mạnh, oxi hóa mạnh và có tính háo nước.
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2 H2O
- Tác dụng với các chất khử khác
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau:
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
Lưu ý:
- Bài tập kim loại tác dụng với axit sunfuric đặc thường gặp nhất là tạo khí SO2, khi giải thường vận dụng bảo toàn e và bảo toàn nguyên tố:
ne = nkim loại.hóa trịkim loại = 2nSO2
nH2SO4 phản ứng = 2nSO2
mmuối = mkim loại + 96nSO2
- H2SO4 đặc nguội thụ động với Al, Fe và Cr.
- H2SO4 đặc phản ứng được với hầu hết các kim loại (trừ Au và Pt) → muối trong đó kim loại có hóa trị cao + H2O + SO2 (S, H2S).
- Sản phẩm khử của S+6 tùy thuộc vào độ mạnh của kim loại: kim loại có tính khử càng mạnh thì S+6 bị khử xuống mức oxi hóa càng thấp.
Điểu chế H2SO4:
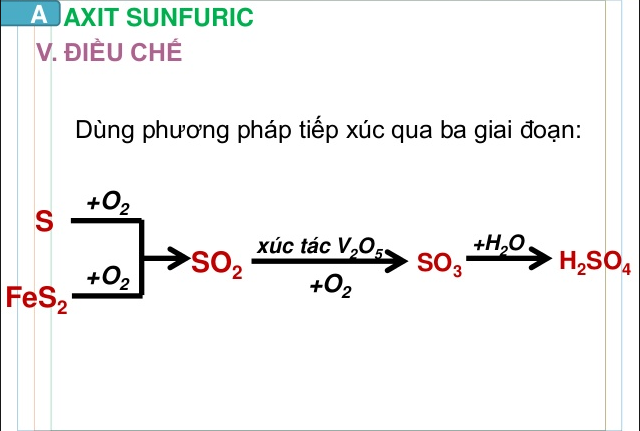
FeS2 hoặc S → SO2 → SO3 → H2SO4
- Đốt cháy quặng firit sắt.
4FeS2 + 11O2 → 8SO2 + 2Fe2O3
- Oxi hóa SO2 bằng oxi trong điều kiện 400 - 5000C, xúc tác V2O5)
2SO2 + O2 → 2SO3
- Axit sunfuric đặc hấp thụ SO3 tạo thành oleum có công thức tổng quát là H2SO4.nSO3.
nSO3 + H2SO4 → H2SO4 .nSO3
- Pha loãng oleum thành axit sunfuric bằng lượng nước thích hợp
H2SO4 .nSO3 + (n+1) H2O→ (n+1)H2SO4
Các dạng của axit sunfuric:
- Mặc dù có thể sản xuất axit sunfuric 100%, nhưng nó sẽ mất SO3 ở điểm sôi để tạo ra axit 98,3%. Các nồng độ khác nhau của axit sunfuric được sử dụng với những mục đích khác nhau có thể kể đến như:
- Axit sunfuric loãng dùng trong phòng thí nghiệm thường chỉ có 10%.
- Dùng cho ắc quy khoảng 33,5%.
- Hàm lượng 62,18% là axit được dùng để sản xuất phân bón.
- 77,67% được dùng trong tháp sản xuất hay axit glover.
- 98% là axit đậm đặc.
Ứng dụng:
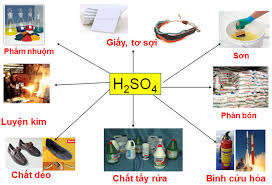
Axit sunfuric là hóa chất hàng đầu được dùng trong nhiều ngành công nghiệp sản xuất. Hàng năm, các nước trên thế giới sản xuất khoảng 160 triệu tấn H2SO4 dùng để sản xuất phân bón, thuốc trừ sâu, chất giặt tẩy rửa tổng hợp, tơ sợi hóa học, chất dẻo, sơn màu,....
Axit sunfuric được sản xuất trong công nghiệp từ lưu huỳnh, oxy và nước theo phương pháp tiếp xúc.
Như vậy là chúng ta đã trải qua xong chuyên mục lưu huỳnh và các hợp chất, hy vọng đã giúp bạn đọc hiểu thêm về loại hóa chất này. Rất mong các bạn đọc tiếp tục đồng hành cùng với Wikihoidap.org trong các bài viết kế tiếp. Thân chào và hẹn gặp lại!



