-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Các oxit và hidroxit của lưu huỳnh? Tính chất và ứng dụng?
Sau khi đã tìm hiểu về lưu huỳnh qua những khái niệm, những tính chất, cũng như là ứng dụng. Wikihoidap sẽ cùng bạn đọc tìm hiểu sâu hơn về các hợp chất của nguyên tố này. Cùng tìm hiểu nhé!
Danh mục nội dung
SO2 (Lưu huỳnh điôxit hay anhiđrit sunfurơ)
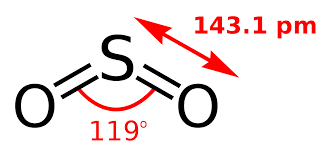
SO2 là sản phẩm chính của sự đốt cháy hợp chất lưu huỳnh và nó là một mối lo môi trường đáng kể. SO2 thường được mô tả là "mùi hôi của lưu huỳnh bị đốt cháy". Là nguyên nhân gây ra hiện tượng mưa axit.
Tính chất vật lý của SO2:
Lưu huỳnh điôxit là một khí vô cơ không màu, nặng hơn không khí, mùi hắc, độc, tan và tác dụng được với nước.
Tính chất hóa học của SO2:
SO2 là một ôxit axit, tan trong nước tạo thành dung dịch axit yếu H2SO3 (nhưng nó vẫn có đầy đủ tính chất hóa học của axit). H2SO3 mạnh hơn axit sunfuhidric và axit cacbonic.
SO2 + H2O → H2SO3
-
Tác dụng với dung dịch bazơ:
SO2 + NaOH → NaHSO3
SO2 + NaOH → Na2SO3 + H2O
Lưu ý: Tùy vào tỉ lệ mà khi tác dụng với dung dịch bazơ sẽ tạo ra 2 loại muối khác nhau sunfit và hidrosunfit.
-
Tác dụng oxit bazơ:
SO2 + CaO → CaSO3
SO2 vừa có tính khử, vừa có tính oxi hóa (vì có số oxi hóa +4 nằm giữa các số oxi hóa khác)
-
Tính oxi hóa:
SO2 + 2H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
-
Tính khử:
SO2 + Br2 + 2H2O → 2HBr + H2SO4
5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
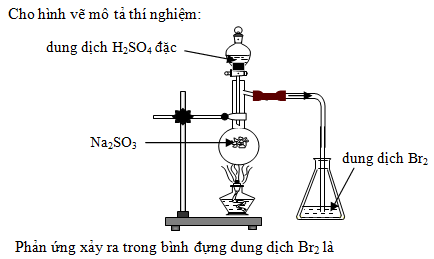
Điều chế SO2:
-
Trong phòng thí nghiệm:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
-
Trong công nghiệp:
- Đốt lưu huỳnh: S + O2 (to) → SO2
- Đốt pyrit sắt (FeS2):
4FeS2 + 11O2 → 2Fe2O3 + 8SO2
-Cho kim loại tác dụng với H2SO4 đặc, nóng:
|
Cu |
+ |
2H2SO4 |
→ |
2H2O |
+ |
SO2 |
+ |
CuSO4 |
(Thu SO2 bằng cách đẩy không khí)
Nhận biết SO2:
- Làm quỳ tím ẩm chuyển thành màu đỏ.
- Làm mất màu dung dịch nước brom, dung dịch thuốc tím... ( 2 phương trình tính khử)
Ứng dụng SO2:
- Sản xuất axit sunfuric(Ứng dụng quan trọng nhất)
- Tẩy trắng giấy, bột giấy, tẩy màu dung dịch đường
- Đôi khi được dùng làm chất bảo quản cho các loại quả sấy khô như mơ, vải..., do thuộc tính chống nấm mốc, và nó được gọi là E220 khi sử dụng vào việc này ở châu Âu. Với công dụng là một chất bảo quản, nó duy trì màu sắc, mẫu mã đẹp của hoa quả và chống sự thối rữa. Nó cũng được dùng làm chất kháng khuẩn và chống ôxi hóa trong sản xuất rượu vang hay làm chất bảo quản và tẩy màu cho mật đường.
SO3 (Lưu huỳnh triôxit)
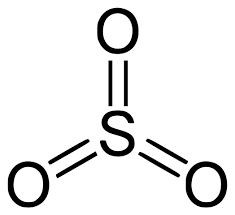
Là chất lỏng không màu, tan vô hạn trong nước và axit sulfuric. Trioxide lưu huỳnh khô tuyệt đối không ăn mòn kim loại. Ở thể khí, đây là một chất gây ô nhiễm nghiêm trọng và là tác nhân chính trong các trận mưa axit.
Cấu tạo và liên kết của SO3:
Khí SO3 có cấu tạo phân tử tam diện phẳng và đối xứng, như được dự đoán trước bởi lý thuyết VSEPR.
Nguyên tử lưu huỳnh có chỉ số oxy hóa là +6, điện tích là 0 và bao quanh bởi 6 cặp electron.
Tính chất hóa học của SO3:
SO3 là chất anhydrit của H2SO4. Do đó, các phản ứng sau sẽ xảy ra:
SO3 + H2O → H2SO4 ( phản ứng tỏa nhiều nhiệt )
Lưu huỳnh trioxit cũng phản ứng với lưu huỳnh diclorua để tạo ra chất thuốc thử hữu dụng thionyl clorua.
SO3 + SCl2 → SOCl2 + SO2
Ở nhiệt độ cao Lưu huỳnh trioxit bị nhiệt phân khi có chất xúc tác là oxit vanadi (V).
SO3 → SO2 + O2
Ứng dụng của SO3:
SO3 ít có ứng dụng trong thực tế, nhưng lại là sản phẩm trung gian để sản xuất axit sunfuric.
Trong công nghiệp người ta sản xuất SO3 bằng cách oxi hóa SO2:
2SO2 + O2 → 2SO3 (với xúc tác V2O5, ở nhiệt độ cao khoảng 450 - 500 °C)
H2S (Hydro sunfua)
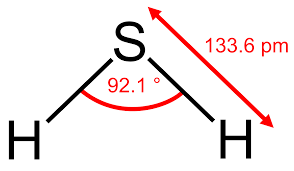
Tính chất vật lý của H2S:
H2S là hợp chất khí ở điều kiện nhiệt độ thường, không màu, mùi trứng thối, nặng hơn không khí, rất độc. Chỉ 0,1% H2S trong không khí đã gây nhiễm độc mạnh. Hóa lỏng ở −600C, hóa rắn ở −860C.
Tính chất hóa học của H2S:
Tính axit yếu:
Khí H2S tan trong nước tạo thành dung dịch axit sunfuahiđric rất yếu (yếu hơn axit H2CO3). Axit sunfuahiđric tác dụng với các dung dịch bazơ như NaOH, tạo nên 2 loại muối: muối trung hòa chứa ion S2- hay muối axit chứa ion HS-, tùy vào tỉ lệ các chất tham gia phản ứng.
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaHS + H2O
Đặc biệt H2S tác dụng với các dung dịch muối cacbonat kim loại kiềm chỉ tạo ra muối hiđro cacbonat.
H2S + Na2CO3 → NaHCO3 + NaHS
Tính khử mạnh:
- Trong axit H2S và các muối của nó (S có số oxi hoá -2) nên là chất khử mạnh. H2S cháy trong không khí với ngọn lửa màu xanh.
2H2S + 3O2 → 2 H2O + 2SO2
- Nếu không cung cấp đủ không khí, H2S bị oxi hóa thành S. Clo có thể oxi hoá H2S thành H2SO4 (khi có nước).
4Cl2 + H2S + 4H2O → H2SO4 + 8 HCl
- H2S tác dụng với các kim loại kiềm tạo thành muối axit.
2H2S + 2K → 2KHS + H2
- Còn với các kim loại khác thì tạo thành muối sunfua. H2S khan không tác dụng với Cu, Ag, Hg, nhưng khi có mặt hơi nước thì lại tác dụng khá nhanh làm cho bề mặt các kim loại này bị xám lại.
4 Ag + 2H2S + O2 → 2Ag2S + 2H2O
Trạng thái tự nhiên và điều chế:
Trong tự nhiên H2S có trong một số nước suối, trong khí núi lửa và bốc ra từ xác chết của người và động vật...
Trong công nghiệp người ta không sản xuất H2S. Trong phòng thí nghiệm, người ta điều chế bằng phản ứng hóa học của HCl với FeS:
2HCl + FeS → FeCl2 + H2S
Wikihoidap.org đã cung cấp cho bạn đọc về tính chất và ứng dụng của các oxit và hợp chất của lưu huỳnh. Còn một bài phân tích về axit sunfuric là chúng ta sẽ có những kiến thức tổng quan nhất về lưu huỳnh cũng như các hợp chất chứa lưu huỳnh. Hãy đón đọc bài viết mới nhất cùng Wikihoidap.org. Thân chào và hẹn gặp lại!



