-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
HỢP CHẤT CỦA SILIC
Sau khi đã biết silic là gì? Nguyên tử khối của silic? Tính chất hóa học của silic? Điều chế và ứng dụng trong đời sống của silic? Trong bài viết này chúng ta sẽ tìm hiểu rộng hơn về các hidroxit của nguyên tố silic, nhằm trang bị các kiến thức hữu ích hỗ trợ bạn đọc trong công việc và học tập.
Danh mục nội dung
SILIC ĐIOXIT (SiO2)
I. Tính chất vật lí và trạng thái tự nhiên
- Là chất ở dạng tinh thể nguyên tử, không tan trong nước.
- Trong tự nhiên chủ yếu tồn tại ở dạng khoáng vật thạch anh.
II. Tính chất hóa học
- SiO2 có tính chất của oxit axit, tan chậm trong dung dịch kiềm và tan dễ trong kiềm nóng chảy hoặc cacbonat kim loại kiềm nóng chảy → silicat:
SiO2 + 2NaOH → Na2SiO3 + H2O
SiO2 + Na2CO3 → Na2SiO3 + CO2
- SiO2 tan dễ trong axit HF:
SiO2 + 4HF → SiF4 + 2H2O
Phản ứng này dùng để khắc chữ trên thủy tinh → không dùng bình thủy tinh để đựng axit HF.
III. Điều chế
Dù silica phổ biến trong tự nhiên nhưng người ta cũng có thể tổng hợp được theo nhiều cách khác nhau:
- Bằng cách cho silic phản ứng với oxi ở nhiệt độ cao:(theo sgk hóa 9)
Si (r) + O2 (k) → SiO2 (r)
(phương pháp này thường được áp dụng để phủ lớp SiO2 trên bề mặt silic)
- Phương pháp phun khói (thủy phân silic halogel ở nhiệt độ cao với oxy và hyđro)
2H2 + O2 + SiCl4 → SiO2 + 4HCl
- Phương pháp kết tủa (Cho thủy tinh lỏng phản ứng với 1 axit (vô cơ).
Na2SiO3 + H+ → 2Na+ + SiO2 + H2O
- Phương pháp sol-gel (Thủy phân một alkoxysilan với xúc tác bazơ hoặc axit)
Si(OR)4 + 2H2O → SiO2 + 4ROH
Axit silixic (H2SiO3)
- Là chất ở dạng keo, không tan trong nước, dễ mất nước khi đun nóng. Khi sấy khô, axit silixic mất một phần nước, tạo thành vật liệu xốp là silicage có khả năng hấp phụ mạnh được dùng để hút hơi ẩm trong các thùng đựng hàng hóa.
H2SiO3 → H2O + SiO2 điều kiện: (t0)
- Axit silicic dễ tan trong dung dịch kiềm tạo thành dung dịch muối silicat của kim lọai kiềm.
H2SiO3 + 2NaOH → Na2SiO3 + 2H2O
- Là axit rất yếu nên dễ bị khí cacbon đioxit đẩy ra khỏi dung dịch muối silicat.
Na2SiO3 + 2HCl → 2NaCl + H2SiO3
Na2SiO3 + CO2 + H2O → H2SiO3 + Na2CO3
SiCl4 + 3H2O → H2SiO3 + 4HCl
Muối silicat
- Là muối của axit silicic thường không màu, khó tan (trừ muối kim loại kiềm tan được).
- Dung dịch đậm đặc của Na2SiO3 được gọi là thủy tinh lỏng được dùng để chế tạo keo dán thủy tinh và sứ, bảo quản vải và gỗ khỏi bị cháy. Trong dung dịch, silicat của kim loại kiềm bị thủy phân mạnh tạo môi trường bazơ:
Na2SiO3 + 2H2O → 2Na+ + 2OH‑ + H2SiO3
Dung dịch đậm đặc của Na2SiO3 và K2SiO3 được gọi là thủy tinh lỏng. Vải hoặc gỗ tẩm thủy tinh lỏng sẽ khó bị cháy. Thủy tinh lỏng còn được dùng để chế tạo keo dán thủy tinh và sứ.
Bài tập bổ trợ
Bài 1 (trang 79 SGK Hóa 11):
Nêu những tính chất hóa học giống và khác nhau giữa silic và cacbon. Viết các phương trình hóa học để minh họa ?
Lời giải:
- Giống nhau: C và Si đều thể hiện tính khử hoặc tính oxi hóa trong các phản ứng hóa học
+ ví dụ: tác dụng với oxi, tác dụng với kim loại
- Khác nhau:
+ C có tính khử mạnh hơn Si nên khử được một số oxit kim loại
+ Si có khả năng tác dụng được với dung dịch NaOH
Lời giải chi tiết
- C và Si đều thể hiện tính khử hoặc tính oxi hóa trong các phản ứng hóa học
+ Đều có tính oxi hóa: ( tác dụng được với một số kim loại)
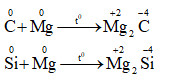
+ Đều có tính khử : ( tác dụng với một số phi kim)
- Khác nhau:
+ Si tác dụng mạnh được với dung dịch kiềm giải phóng khí H2 còn C thì không
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
+ C khử được một số oxit kim loại còn Si thì không khử được
C + 2FeO → 2Fe + CO2↑ điều kiện: nhiệt độ
Bài 4 (trang 79 SGK Hóa 11):
Từ SiO2 và các hóa chất cần thiết khác, hãy viết phương trình hóa học của các phản ứng điều chế axit silixic?
Lời giải:
Sơ đồ: SiO2 → Na2SiO3 → H2SiO3
Phương trình phản ứng:
SiO2 + 2NaOH → Na2SiO3 + H2O
Na2SiO3 + 2HCl → 2NaCl + H2SiO3 ↓



