-
Câu Hỏi
1868
-
Thành Viên
799
-
Wiki-Hỏi-Đáp.Org
Wiki Hỏi đáp trực tuyến là website chia sẻ kiến thức cộng đồng về tất cả lĩnh vực từ giáo dục, kinh tế, xã hội khoa học, đời sống, gia đình...
Liên hệ tại: Wikihoidap.org@gmail.com
Liên kết hữu ích bạn nên xem: Alo789
-
Theo dõi Wiki Hỏi đáp
-
Bản quyền tại DMCA
Phản ứng oxi hóa khử là gì? Cách cân bằng phản ứng oxi hóa khử?
Phản ứng oxi hóa khử chắc hẳn là một phần khá là khó xơi trong Hóa phổ thông, nó là nền tảng trong việc học tốt môn học này. Vậy phản ứng oxi hóa khử là gì? Làm thế nào để thiết lập, cũng như cân bằng phương trình này? Cùng Wikihoidap.org tìm hiểu qua bài viết dưới đây nhé.

Danh mục nội dung
Định nghĩa phản ứng oxi hóa khử:
- Chất khử (chất bị oxi hoá): là chất nhường electron hay là chất có số oxi hoá tăng sau phản ứng.
- Chất oxi hoá (chất bị khử): là chất nhận electron hay là chất có số oxi hoá giảm sau phản ứng.
- Sự khử: là quá trình làm cho chất đó nhận electron hay làm giảm số oxi hoá của chất đó.
- Sự oxi hoá: là quá trình làm cho chất đó nhường electron hay làm tăng số oxi hoá của chất đó.
Phản ứng oxi hoá khử là phản ứng hoá học trong đó có sự chuyển electron giữa các chất phản ứng, hay còn gọi là phản ứng có sự thay đổi số oxi hóa của các nguyên tố.
Chú ý:
+ Khử thì cho, O ( oxi hoá ) thì nhận (cho thì tăng, nhận thì giảm)
+ Chất oxi hoá thì có quá trình khử (sự khử), chất khử thì có sự oxi hoá.
+ Chất oxi hoá và chất khử luôn có mặt ở vế trái của một phản ứng oxi hoá khử.
+ Dấu hiệu để nhận ra phản ứng oxi hoá khử là có sự thay đổi số oxi hoá của một hay một số nguyên tố nào đó.
Ví dụ: Ta xét phương trình sau:
2Mg + O2 → 2MgO (1)
Số oxh của Mg tăng từ 0 lên +2 ð Mg nhường electron
Số oxh của Oxi giảm từ 0 xuống -2 ð Oxi nhận electron
Quá trình Mg nhường electron là quá trình oxh Mg.
Ở phản ứng (1): Chất oxh là oxi, chất khử là Mg.
VD2: 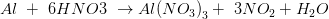
x 1 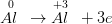
x 3 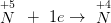
Cách xác định số oxi hóa:
Vì đây là mấu chốt trong việc hiểu hết toàn bộ kiến thức về phản ứng oxi hóa khử, nên chúng ta sẽ phân tích sâu hơn phần này ở một bài riêng, các bạn hãy tìm và đón đọc trên Wikihoidap.org nhé!
https://wikihoidap.org/cach-xac-dinh-so-oxi-hoa
Cách cân bằng phản ứng oxi hóa khử:
Nguyên tắc chung: Với mục đích nhằm cân bằng phản ứng oxi hóa khử chính là số điện tử cho của chất khử phải bằng số điện tử nhận của chất oxi hóa hay số oxi hóa tăng của chất khử phải bằng số oxi hóa giảm của chất oxi hóa. Hiện tại, có rất nhiều phương pháp để cân bằng phản ứng này, nhưng Wikihoidap.org sẽ cung cấp những phương pháp cơ bản nhất nhằm giúp bạn đọc dễ theo dõi.
Phương pháp nguyên tử nguyên tố:
Nội dung: Khi cân bằng ta cố ý viết các đơn chất khí (H2, O2, Cl2, N2...) dưới dạng nguyễn tử riêng biệt rồi lập luận qua một số bước.
Ví dụ cụ thể: Cân bằng phản ứng hóa học: P + O2 → P2O5
Ta viết như sau: P + O → P2O5
Để tạo thành 1 phân tử P2O5 cần 2 nguyên tử P và 5 nguyên tử O:
2P + 5O → P2O5
Tuy nhiên phần tử oxi bao giờ cũng gồm hai nguyên tử, như vậy nếu lấy 5 phân tử oxi tức là số nguyên tử oxi tăng lên gấp 2 thì số nguyên tử P và số phân tử P2O5 cũng tăng lên gấp 2, tức 4 nguyên tử P và 2 phân tử P2O5
Vì thể: 4P + 5O2 → 2P2O5
Phương pháp đại số:
Phương pháp này dựa trên nguyên tắc tổng số moi nguyên tử của mỗi nguyên tô hoá học không thay đổi trong phản ứng hóa học.
Ví dụ: Lập PTHH của phản ứng có sơ đồ :
Fe3O4 + CO ——> Fe +CO2
Bước 1: Đặt hệ số là các ẩn số
a Fe3O4 + b CO ——> c Fe + d CO2
Bước 2: Thiết lập các phương trình bảo toàn nguyên tử của các nguyên tô hoá học.
Nguyên tố sắt: 3a = c (I)
Nguyên tố cacbon: b = d (II)
Nguyên tố oxi: 4a + b = 2d (III)
Bước 3: giải hệ phương trình đại số vừa thiết lập ở bước (2) tìm tỉ lệ a : b : c tối giản và nguyên. Từ đó chọn được hệ số thích hợp thế (II) vào (III) → 4a + d = 2d → 4a = d. (IV), (I). (II), (III) → a : b : c : d = 1 : 4 : 3 : 4.
Bước 4: Viết hệ số vừa chọn vào trước CTHH trong PT
Fe3O4 + 4 CO ——> 3 Fe + 4 CO2
Nhân xét: PPĐS là phương pháp thiết lập PƯHH chung, có thể áp dụng cho sơ đồ phản ứng hoá học bất kì, không phụ thuộc việc tính số oxi hoá. Trong một số trường hợp, phương pháp này cho phép thiết lập PƯOK rất nhanh. Ví dụ: lập PTHH có sơ đồ sau:
KMnO4 + HCl → KCl + MnCl2 + Cl2 + H2O
Nhận thấy Oxi chỉ có trong KMnO4 (về trái) và trong H2O (về phải) có đơn chất Cl2 (về phải) dùng PPĐS: cân bằng oxi —> cân băng H, K, Mn —> cân bằng Cl sau cùng, ta được: KMnO4 + 8HCl → KCl + MnCl2 + 2,5Cl2 + 4H2O
—> Nhân cả 2 về của PTHH trên với 2 ta được
2KMnO4 + 8HCl → 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Chú ý: Trong một số phản ứng oxi hóa khử phức tạp do có quá nhiều ẩn hoặc quá nhiều phương trình đồng thời chỉ áp dụng được phương pháp này khi đã biết rõ sơ đồ phản ứng.
Phương pháp hóa trị tác dụng
Hóa trị tác dụng là hỏa trị của nhóm nguyễn tử hay nguyên tử của các nguyên tổ trong chất tham gia và tạo thành trong PƯHH. Khi áp dụng phương pháp này, ta cần tiến hành các hước sau:
- Xác định hóa trị tác dụng
- Lấy BSCNN chia cho các hóa trị ta sẽ được các hệ số.
Phương pháp dùng hệ số phân số
Với phương pháp dùng hệ số phần số, các hệ số vào các công thức của các chất tham gia phản ứng, không phân biệt số nguyên hay phân số sao cho số nguyên tử của mỗi nguyên tố ở hai vế bằng nhau. Sau đó khử mẫu số chung của tất cả các hệ số.
Phương pháp “chẵn - lẻ”
Nguyên tắc: Một phản ứng sau khi đã cân bằng thì số nguyên tử của một nguyên tố ở vế trải bằng số nguyên tử nguyên t�� đó ở vế phải. Vì vậy nếu số nguyên tử của một nguyên tố ở một vế là số chẵn thì số nguyên tử nguyên tố đó ở vế kia phải chẵn. Nếu ở một công thức nào đó số nguyên tử nguyên tố đó còn lẻ thì phải nhân đôi.
Phương pháp xuất phát từ nguyên tố chung nhất
Nguyên tắc phương pháp: Chọn nguyên tố có mặt ở nhiều hợp chất nhất trong phản ứng để bắt đầu cân bằng hệ số các phân tử.
Trên đây là những thông tin cơ bản nhất về phản ứng oxi hóa khử, hy vọng cung cấp cho bạn đọc những cái nhìn tổng quát nhất về phần khó nhằn này. Hãy tiếp tục đồng hành cùng Wikihoidap.org nhé!



